Eléments essentiels de la pratique médicale et de la médecine de précision
Les biomarqueurs et les diagnostics sont les éléments-clés pour diagnostiquer une maladie ou un processus pathogène, pour surveiller les patients pendant leur traitement, pour mesurer la réponse du patient à une exposition ou une thérapie.
Dans le domaine de la médecine de précision, les marqueurs biologiques et les diagnostics sont le support pour prédire et surveiller la réponse des patients aux traitements, en d’autres termes pour identifier les différentes sous-populations de patients les plus susceptibles de bénéficier de traitements prédéterminés.
Qu’est-ce qu’un biomarqueur ?
Selon la FDA et le NIH, un biomarqueur (ou marqueur biologique) est ”une caractéristique définie qui est mesurée comme un indicateur des processus biologiques normaux, des processus pathogènes ou des réactions à une exposition ou une intervention, y compris les interventions thérapeutiques “.
Un marqueur biologique peut être n’importe quel indicateur biologique mesurable. Par exemple, les biomarqueurs peuvent être cellulaires ou moléculaires (ADN, ARN, protéines, métabolites). Ils sont mesurés à partir d’une biopsie tissulaire ou d’une biopsie liquide (sang, urine, salive….). D’autres biomarqueurs (physiologiques, morphologiques, etc.) peuvent également être utilisés ou mesurés par imagerie clinique ou médicale.
Les biomarqueurs peuvent être quantitatifs ou qualitatifs.
Les biomarqueurs qualitatifs pourraient être impliqués dans la détection d’un processus pathogène dans le cadre d’une analyse oui/non, tandis que les biomarqueurs quantitatifs sont impliqués dans la détection d’un processus pathogène avec un effet seuil.
Les biomarqueurs sont utilisés dans la recherche et la pratique clinique pour :
> Diagnostiquer les maladies ou prévoir les risques de maladie,
> Surveiller les personnes en bonne santé pour détecter les signes précoces de la maladie,
> Déterminer si un traitement est efficace ou non,
> Cibler des groupes spécifiques de personnes pour lesquelles un médicament particulier peut être utile,
> Produire des médicaments plus sûrs en prédisant plus tôt le potentiel d’effets indésirables,
> Permettre aux chercheurs d’avoir une vision globale des événements et des changements qui se produisent en permanence au sein d’une cellule.
Des biomarqueurs pour développer des diagnostics
La plupart des diagnostics sont basés sur des marqueurs biologiques. Tous les diagnostics in vitro sont basés sur des biomarqueurs.
La première étape du développement d’un diagnostic consiste à identifier un ou plusieurs biomarqueurs associés à un processus biologique normal ou pathogène, ou à la réponse du patient à un traitement prédéterminé.
La validation clinique de marqueurs biologiques, physiologiques ou morphologiques déterminera quel marqueur ou quelle combinaison de marqueurs est fiable, pertinent(e) et spécifique à la mesure d’un processus prédéterminé ou à la réponse du patient à une thérapie.
La biologie moléculaire basée sur les biomarqueurs génomiques, transcriptomiques, protéomiques ou métabolomiques permet de développer des diagnostics précis, notamment en médecine de précision.
Ce domaine de la médecine de précision nécessite l’identification et la validation clinique d’un grand nombre de biomarqueurs pour prédire l’évolution de la maladie, suivre son évolution, identifier les différentes sous-populations de patients et prévoir et surveiller la réponse des patients à la plupart des traitements.
En effet, peu de thérapies basées sur des médicaments spécifiques sont prescrites grâce au résultat du diagnostic. Aujourd’hui, peu de diagnostics compagnons sont déjà sur le marché, à l’exception du cancer du sein, du cancer du colon ou du mélanome.
Plusieurs autres domaines médicaux nécessitent le développement et la commercialisation de nouveaux diagnostics. Ainsi, plusieurs thérapies, comme le cancer du pancréas ou la maladie d’Alzheimer, nécessitent encore l’identification de biomarqueurs spécifiques pour établir un processus biologique pathologique.
De plus, le diagnostic de plusieurs pathologies (tumeurs solides, par exemple) serait mieux accepté ou réalisé s’il pouvait l’être sur la base de biomarqueurs issus de biopsies liquides (sang, urine, salive…).
Les biomarqueurs en routine : un objectif encore difficile à atteindre
La plupart des médecins sont habitués au rôle des tests diagnostiques pour clarifier et appuyer leur prise de décision clinique. Au cours des dernières années, le processus de diagnostic a été de plus en plus fortement influencé par la nécessité de présélectionner les patients en fonction des noms ou des classifications des médicaments.
Cette évolution s’explique par un certain nombre de facteurs, par lesquels :
> l’avancement de la technologie (qui nous permet de mesurer des marqueurs d’efficacité plus spécifiques),
> une meilleure compréhension du processus de la maladie,
> une meilleure appréciation du caractère unique du phénotype d’un individu au niveau moléculaire.
Cette décision est également motivée par des facteurs sociétaux, dont le plus important est la nécessité de limiter les thérapies ciblées aux patients les plus susceptibles d’en bénéficier. Avec l’avènement de la médecine de précision, l’approche médicale dite de la ”taille unique“ fait partie de l’histoire.
La promesse fondamentale de la médecine personnalisée est que le diagnostic et le traitement des maladies deviendront toujours plus rapides, moins chers, plus précis et plus efficaces.
L’intérêt naissant des payeurs à s’assurer que les médicaments sont administrés aux bons patients façonnera probablement aussi l’association entre les diagnostics et les régimes d’assurance-médicaments dans l’avenir.
En effet, passer des biomarqueurs au diagnostic utilisé en pratique clinique en passant par les affaires réglementaires est un défi majeur. L’application des approches génomiques à de nombreuses tumeurs malignes a produit des milliers de biomarqueurs candidats pour la détection et le pronostic, mais très peu se sont établis dans la pratique clinique en raison principalement du manque de résultats cliniques validés…
Le défi des biomarqueurs du cancer dans la pratique clinique
Dans le traitement du cancer, les pratiques cliniques “usuelles” sont remplacées par de nouvelles approches. Traditionnellement, les patients atteints de cancer étaient traités avec des médicaments de faible toxicité ou de haute tolérance, peu importe leur efficacité chez un patient donné, si les bienfaits de ce médicament sont prouvés dans des conditions expérimentales et cliniques. Cependant, les progrès récents de la recherche fondamentale et clinique ont permis d’élaborer des stratégies de traitement “personnalisé”.
Ces nouvelles approches visent à déterminer les avantages individuels des thérapies pour les patients, à minimiser le risque de toxicité et à réduire le coût du traitement.
La mise au point de diagnostics dédiés pour guider l’utilisation de thérapies ciblées dans le domaine de l’oncologie offre la perspective de meilleurs résultats thérapeutiques et d’une exposition réduite à la toxicité pour de nombreux patients. L’émergence récente de stratégies de sélection et de surveillance des biomarqueurs pour la sélection et la surveillance des traitements démontre les promesses des biomarqueurs dans le domaine du cancer.
Il existe actuellement 32 biomarqueurs valides répertoriés par la FDA dans toute une gamme de domaines thérapeutiques, le cancer étant le plus important.
Pour les biomarqueurs dans l’application du cancer, les défis ainsi que les avantages semblent énormes. Pour faire les progrès nécessaires dans le traitement du cancer, la maladie d’un patient doit être surveillée de manière efficace et efficiente.
Aujourd’hui, les traitements peuvent être prescrits à un grand nombre de patients, malgré l’incertitude quant à leur degré de réponse au traitement. Un exemple de ceci est la chimiothérapie systémique offerte localement aux patients atteints d’un cancer du pancréas avancé avec des taux de réponse allant d’un seul chiffre à environ 30 %. L’utilisation systématique de la chimiothérapie adjuvante pour le cancer du rectum à la suite d’une chimioradiation néoadjuvante est remise en question. Ce traitement excessif dans certains cas, ou l’approche ” d’essai et d’erreur ” dans d’autres, manque de précision, entraîne des effets secondaires, la progression possible de la maladie, et est considéré par beaucoup comme déraisonnablement coûteux. Idéalement, des biomarqueurs thérapeutiques devraient être utilisés pour guider ces décisions thérapeutiques critiques.

Des milliers d’articles ont été rédigés dans le cadre de projets de découverte de biomarqueurs, mais seuls quelques biomarqueurs cliniquement utiles ont été validés avec succès pour la pratique clinique courante.
Voici les principaux pièges à éviter pour passer de la découverte de biomarqueurs à leur utilité clinique :
1. Absence de choix différents avant d’entamer la phase de découverte.
2. Absence de stratégie de caractérisation/validation des biomarqueurs.
3. Robustesse des techniques d’analyse utilisées dans les essais cliniques.
Le choix des biomarqueurs utiles doit être soigneusement évalué et dépend de différents paramètres importants, tels que la conception des essais de validation, la sensibilité, la spécificité, la valeur prédictive, la corrélation clinique, etc. Malheureusement, les biomarqueurs présentant une spécificité et une sensibilité idéales sont difficiles à identifier et à valider en clinique sur un certain nombre de patients adéquats.
Les progrès technologiques récents dans le domaine de l’ADN/ARN et des technologies associées offrent la possibilité d’analyser simultanément un grand nombre de biomarqueurs différents dans le cadre d’une seule expérience. A ces progrès s’ajoute le développement rapide au cours de la dernière décennie d’une approche d’échantillonnage non invasive, comprenant notamment l’intérêt croissant pour les biopsies liquides.
Un nouveau défi pour les partenaires biopharmaceutiques et les sociétés de diagnostic
L’innovation réussie des thérapies ciblées et l’essor de la médecine de précision génèrent une demande croissante pour obtenir des moyens précis et fiables d’identifier en pratique clinique les patients qui bénéficieront d’un traitement prédéterminé.
Encouragée par les autorités de réglementation et de remboursement, cette tendance rapproche plus que jamais les sociétés biopharmaceutiques du monde des sociétés de diagnostic.
Ainsi, les sociétés biopharmaceutiques envisagent des options pour établir un cadre diagnostique d’accompagnement pour la sélection des patients à des stades de développement de plus en plus précoces.
Par conséquent, les biomarqueurs augmentent considérablement leur rôle dans la définition des sous-populations de patients puisqu’ils peuvent mesurer les résultats des essais cliniques et de la pratique clinique.
Le passage du candidat biomarqueur à l’entité de diagnostic est donc un véritable défi pour les promoteurs biopharmaceutiques et les sociétés de diagnostic avec un goulot d’étranglement particulier sur les exigences réglementaires.
L’approche d’Acobiom pour découvrir les biomarqueurs
Au niveau technologique, l’approche d’Acobiom pour découvrir de nouveaux biomarqueurs combine la force du séquençage de nouvelle génération (NGS) pour étudier les changements d’expression des gènes et une suite d’outils bioinformatiques et biostatistiques propriétaires de pointe. Cette suite inclut la possibilité de traiter à grande échelle des données omiques (volumineuses), des processus d’apprentissage machine…
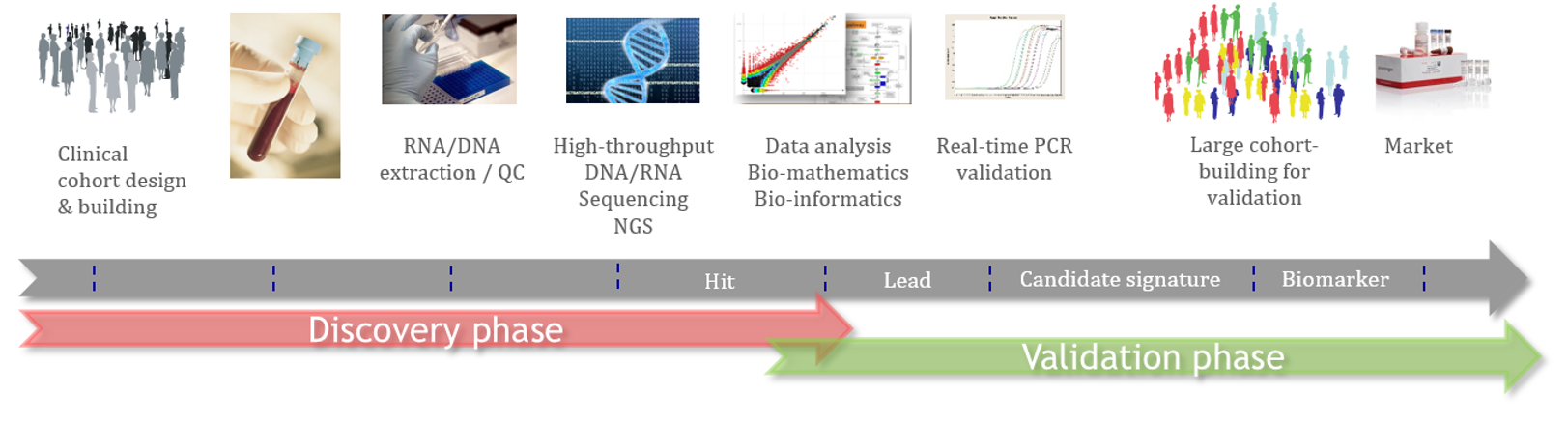
Le processus de découverte de nouveaux biomarqueurs suit un flux scientifique d’étapes successives qui combine des études cliniques, des validations croisées par des technologies différentes/complémentaires, des études analytiques et des outils scientifiques précis.
Cette approche vise à générer des biomarqueurs/diagnostics pouvant être utilisés par les médecins en pratique clinique et conformes aux exigences des autorités sanitaires (UE, FDA).
Ce processus scientifique d’Acobiom permet aux biomarqueurs sélectionnés de passer par le goulot d’étranglement de la sélection et de la validation, tout en augmentant les chances des biopharmas de lancer de nouveaux produits sur le marché.
Dans ce cadre, au cours de ses activités de R&D et de services, Acobiom a identifié des dizaines de biomarqueurs d’ARN en corrélation avec les thérapies/médicaments, le score/développement cognitif, la détection, l’évolution et le pronostic des maladies, la réponse immunitaire, la vaccination, les maladies infectieuses, la pharmacogénomique. Ces biomarqueurs ont été identifiés dans différents types de tissus, d’organes et pour des questions biologiques spécifiques.
En médecine de précision, Acobiom a participé à des études cliniques (et à des essais cliniques) pour identifier des biomarqueurs (sanguins) qui permettent d’identifier les patients les plus susceptibles de bénéficier de traitements prédéterminés.
Par exemple, la société a développé et validé deux diagnostics qRT-PCT :
> GemciTest®, un diagnostic qui peut prédire la réponse du patient au traitement par gemcitabine dans le cancer du pancréas métastatique et de pronostiquer une survie de 15 mois,
> un diagnostic pour pronostiquer une survie positive à 4 ans dans la leucémie myélomonocytaire chronique.

